- ...
- » Лечение в Германии
- » Онкология
- » Таргетная терапия
Таргетная терапия рака в Германии
Онкологические клиники Германии Ведущие врачи-онкологи Германии
В последние годы для борьбы с онкологическими заболеваниями врачи Германии все шире используют новое мощное средство – препараты, действие которых принципиально отличается от традиционной химиотерапии.
Самое распространенное название этого вида лечения рака - таргетная терапия (от англ.: «target» = «цель», «мишень»). Таргетные препараты, применяемые в немецких клиниках, позволяют добиться хорошего терапевтического эффекта даже на поздних этапах злокачественных заболеваний, в том числе при наличии отдаленного метастазирования.
Они на клеточном уровне воздействуют на определенные биологические свойства опухоли, которые отличают ее от здоровых тканей и способствуют ее жизни и росту.
Эти свойства также обозначаются термином «биомаркеры», а лечение, основанное на и их блокировке также называют молекулярно-таргетным или молекулярно-биологическим.
Таргетное лечение в Германии и в России: в чем отличия?
Многие таргетные препараты уже сертифицированы в России. Однако из-за высокой стоимости они не введены в широкую практику, опыта их применения еще недостаточно, нет выверенных алгоритмов так называемой мультимодальной терапии – когда несколько методов (не только медикаментозных, но и, например, радиологических) используются в комплексе, что повышает эффективность лечения. К сожалению, подлинность препаратов, попадающих на российский рынок, также может вызывать сомнения.
В Германии к применению на практике допущены десятки медикаментов новейшего поколения. При диагностике раковых опухолей стандартной процедурой являются анализы для выявления специфических, индивидуальных свойств данной злокачественной ткани. Это позволяет подобрать препарат, который окажет на нее нужное воздействие. Таким образом в Германии лечат уже многие виды рака – как солидные опухоли, так и лимфомы.
Таргетная терапия: общая информация
Прицельная терапия применяется при лечении различных раковых заболеваний - отдельно или в сочетании с химиотерапией или облучением.
Особенно эффективными показали себя биологически активные вещества при лечении определенных форм рака крови (лейкемии с наличием Филадельфийской хромосомы).
Этот новый вид терапии также применяется при онкологии различных органов:
рака почки, кишечника, поджелудочной железы, желудка, простаты,мочевого пузыря, легких, молочной железы, рака кожи (меланома).
В большинстве случаев таргетные препараты назначают при прогрессирующей (метастазирующей) опухоли. Как правило, полного излечения они не дают, но могут существенно замедлить или остановить развитие заболевания, а также облегчить его симптомы.
Перед назначением таргетной терапии проводятся тесты, с помощью которых врачи выявляют особые свойства опухолевых клеток и стуктуры («мишени»), на которые может быть направлено воздействие.
При этом объектом анализа может быть не только ткань опухоли, но и жидкие субстанции, циркулирующие в организме (как правило, кровь). Полученная в рамках так называемой жидкостной биопсии информация позволяет выявлять специфические генетические мутации, генетические изменения или биомаркеры в опухолевых клетках, помогая более точно подобрать прицельно действующие препараты.
Прицельная терапия призвана по возможности атаковать только раковые клетки. Однако действующие вещества также частично затрагивают и здоровые клетки, поэтому и таргетная терапия имеет побочные эффекты, в частности, высыпания на коже и повышение давления. Кроме того, также описаны случаи нарушений в работе щитовидной железы, печени и желудочно-кишечного тракта.
Принципы действия таргетной терапии
Подавление сигналов роста
Раковые клетки растут и размножаются под влиянием сигналов, поступающих извне через сигнальные вещества (их называют «факторы роста»). Эти вещества соединяются с рецепторами на клеточной поверхности. Рецепторы, в свою очередь, транслируют сообщения далее вовнутрь клетки, где они приводят в действие еще более сложные цепочки переноса (трансдукции) сигнала.В итоге сигналы инициируют процессы, необходимые для поддержания жизни и размножения злокачественных клеток.
Эту систему передачи патологического сигнала можно нарушить на разных участках. Эти точки и являются потенциальными целями для целой группы новых препаратов от рака – так называемых ингибиторов сигнальной трансдукции.
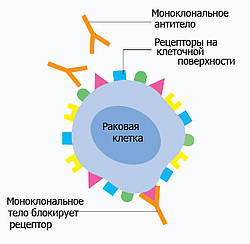
Рецепторы – мишень для моноклональных антител и ингибиторов киназ
Моноклональные антитела (название таких препаратов заканчивается на «маб») - это полученные в лабораторных условиях белки. Каждый такой белок точно соответствует определенному рецептору фактора роста и способен соединяться с ним. После этого рецептор теряет способность соединяться с другими, и клетки больше не получают сигнала, необходимого для нездорового деления.
Например, вещество трастузумаб действует таким образом против рецептора роста HER2, который может в повышенном количестве присутствовать в опухолевых тканях некоторых пациентов с раком желудка и молочной железы. Цетуксимаб прикрепляется к рецептору эпидермального фактора роста (EGFR, англ. epidermal growth factor receptor), увеличенное содержание которого характерно для целого ряда злокачественных опухолей.
Рецепторы также могут быть заблокированы изнутри: так называемые «малые» молекулы проникают в клетку и связываются с внутренней частью рецептора (киназой). Факторы роста при этом по-прежнему соединяются с рецептором, но передача сигнала роста блокируется: отсюда и название «ингибиторы» (то есть «блокаторы») киназ. Названия препаратов из этой группы заканчивается на «mib» или « nib» (например, Гефитиниб и Эрлотиниб).
Ингибиторы тирозинкиназы: действуют на сигнальную цепочку
В цепях передачи сигнала внутри клетки участвуют определенные ферменты. Их называют киназами. Киназы передают сигналы роста внутри клетки. К ним относятся киназы тирозина, которые могут быть заблокированы ингибиторами тирозинкиназы, например (пример – вещество иматиниб), а также mTOR-киназы, против которых действуют соответствующие блокаторы (например, темсиролимус). Есть препараты, которые могут ингибировать несколько киназ. К таким относятся сунитиниб и сорафениб.
Прерывание питания опухоли
Как и любые здоровые клетки, опухолевые клетки нуждаются в кислороде и питательных веществах, чтобы жить и размножаться. При определенном размере опухоли имеющихся кровеносных сосудов становится недостаточно. Поэтому опухолевые клетки стимулируют образование новых кровеносных сосудов. Этот процесс называется «ангиогенез». Ключевым фактором в данном случае является фактор роста эндотелия сосудов (VEGF, от англ. englisch: vascular endothelial growth factor) . Ингибиторы ангиогенеза тормозят образование новых кровеносных сосудов и тем самым предотвращают рост опухоли. С одной стороны, VEGF можно «перехватить» и нейтрализовать, например, с помощью моноклонального антитела бевацизумаб. С другой стороны, передачу сигнала от рецептора VEGF на поверхность клеток кровеносных сосудов могут подавить ибиторы киназ. Так действуют, например, сорафениб и сунитиниб.
Препятствие устранению отходов жизнедеятельности клеток
Чтобы клетка могла регулярно делиться, она избавляется от избыточных молекул белка. Эту задачу выполняет крупный ферментный комплекс - так называемая протеасома. Если функция протеасомы нарушена, клетка больше не может размножаться. Она «задыхается» от своих собственных отходов. Запрограммированная гибель клетки (апоптоз) приводится в движение. Открытие этого механизма привело к разработке препаратов-ингибиторов протеасомы (пример: бортезомиб).
Остановка механизмов ремонта раковой клетки
Опухолевые клетки (также, как и здоровые) во время деления могут восстанавливать поврежденный генетический материал (ДНК). Этому способствует определенный фермент (PARP). PARP-ингибиторы (например, олапариб) подавляют этот процесс. Здоровые клетки организма могут компенсировать ингибирование PARP другими механизмами восстановления ДНК. А в раковых клетках эти альтернативные механизмы восстановления часто нарушаются. Примером являются мутации гена BRCA1 или BRCA2 при наследственном раке молочной железы или яичников. В клетках данных опухолей правильного восстановления не происходит. Если же в них заблокировать еще и зависящий от фермента PARP «ремонтный» механизм, в ДНК злокачественных клеток накапливается все больше и больше «поломок», и они умирают.
Активизация иммунной системы
Когда белки- моноклональные антитела связываются со поверхностными структурами опухолевых клеток (антигенами), это вызывает более или менее сильную иммунную реакцию против маркированных этими антителами опухолевых клеток – это в дополнение к возможному «прицельному» эффекту.
Особый случай воздействия на иммунитет – это так называемые ингибиторы контрольных точек иммунитета (это, например, препараты ипилимумаб и ниволумаб). Они отключают естественный механизм сдерживания иммунной системы организма, который при злокачественных заболеваниях может сыграть отрицательную роль.
Использование онколитических вирусов
Вирусы - это микроскопические частицы, которые заражают клетки организма или проникают в них, а затем используют клеточный генетический механизм для создания своих копий и последующего распространения на окружающие незараженные клетки. Развитие некоторых видов рака ассоциируется с инфицированием определенными вирусами, например – карциномы печени с вирусом гепатита В или шейки матки – с папилломавирусом (ВПЧ).
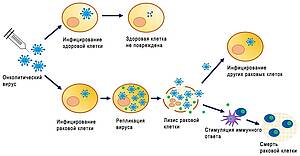
С относительно недавнего времени вирусы стали использовать для поражения уже сформировавшихся опухолей. Речь идет о так называемых онколитических вирусах, отличающихся низкой патогенностью. Они модифицированы таким образом, чтобы избирательно реплицироваться именно в опухолевых клетках, вызывая их распад. Гибель опухолевых клеток сопровождается высвобождением раковых антигенов. Они могут стимулировать иммунный ответ, который будет искать и уничтожать любые оставшиеся опухолевые клетки поблизости и, возможно, в других частях тела.
Таким образом, онколитическая виротерапия - это инновационная форма иммунотерапии, в которой используются природные или генетически модифицированные вирусы для избирательного заражения и уничтожения злокачественной опухоли, при этом нормальные ткани остаются невредимыми.
В настоящее время уже разработаны и применяются препараты онколитической виротерапии меланомы, опухолей головы и шеи, рака мозга (злокачественных глиом).
Ведутся клинические испытания эффективности и безопасности вирусов, действующих против БЦЖ-резистентной карциномы мочевого пузыря и рака молочной железы.
Ограничение в применении прицельных препаратов
Возможности использования таргетных препаратов не безграничны. Во-первых, раковые клетки могут стать резистентными к ним. Это может происходить двумя путями: сам биомаркер изменяет свои свойства в результате мутации и действующее вещество больше не может с ним взаимодействовать, и/или опухоль находит новые способы роста, не зависящие от биомаркера. Поэтому наиболее оптимальным считается использование их комбинации, в том числе и с цитостатиками.
Резюме
Таргетная терапия рака – это персонализированное лечение, направленное против определенных свойств, присущих определенной опухоли.
Важно знать, что:
- Данное лечение показано, только если опухоль имеет соответствующие свойства.
- Таргетные препараты могут применяться отдельно, или в сочетании с химио- или лучевой терапией.
- Прицельная терапия применима не для всех видов рака.
- Таргетные медикаменты могут вызвать побочные эффекты
Ведущие врачи-онкологи Германии Сертифицированные онкологические центры
Запросить информацию о лечении рака в Германии
_________________________
Получить рекомендации по вопросам выезда на лечение в клиники Германии Вы можете по телефонам: (495) 6141736 и (495) 7481117 или отправив нам запрос по электронной почте.